Sadržaj
- smjerovi
- Broj elektrona u valentnom sloju
- Lewisova struktura
- Formalni naboj svakog atoma
- upozorenje
- Što vam je potrebno
Pri određivanju formalnog naboja molekule kao što je CoCl2 (fosgenski plin), potrebno je znati broj elektrona u valentnom sloju svakog atoma i Lewisovu strukturu molekule.
smjerovi
-
Potražite svaki atom u periodnom sustavu elemenata kako biste odredili broj elektrona u valentnom sloju.
-
Podsjetimo se da su dva elektrona u prvim pod-razinama s, dva su u drugoj pod-razini s, šest elektrona u prvoj pod-razini p, i tako dalje. Podsjetimo: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Udari teret. Ako je molekula ion, dodajte ili oduzmite jedan ili više elektrona od ukupnog da biste došli do konačnog naboja.
-
Za CoCl2 (plin fosgen): C = 4; O = 6; Cl = 7. Molekula nije ionizirana i ima neutralan naboj. Stoga je ukupan broj elektrona u valentnom sloju 4 + 6 + (7x2) = 24.
Broj elektrona u valentnom sloju
-
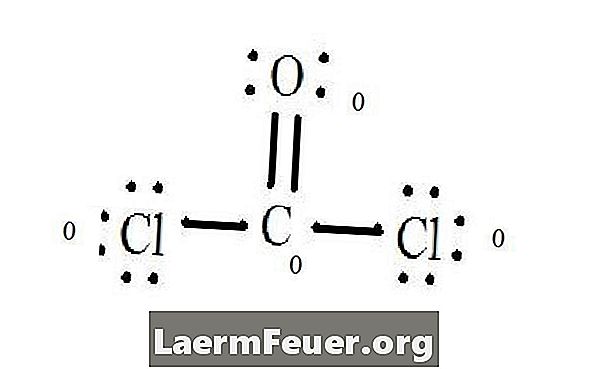
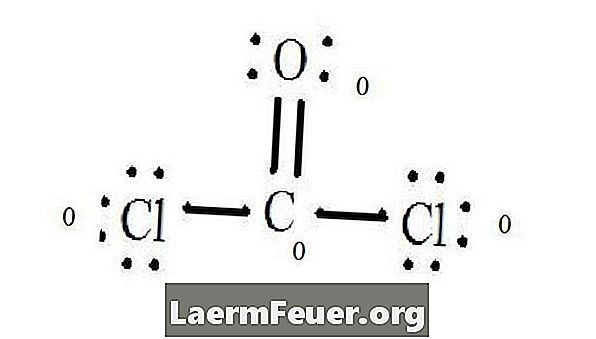
Vidi Lewisov dijagram strukture CoCl2 (fosgenski plin). Lewisova struktura predstavlja najstabilniju i najvjerojatniju strukturu molekule. Atomi se izvlače s uparenim valentnim elektronima; veze između slobodnih elektrona nastaju da zadovolje pravilo okteta.
-
Nacrtajte svaki atom i njegove valentne elektrone, a zatim formirajte veze prema potrebi.
Elektroni su nacrtani na Lewisovoj strukturi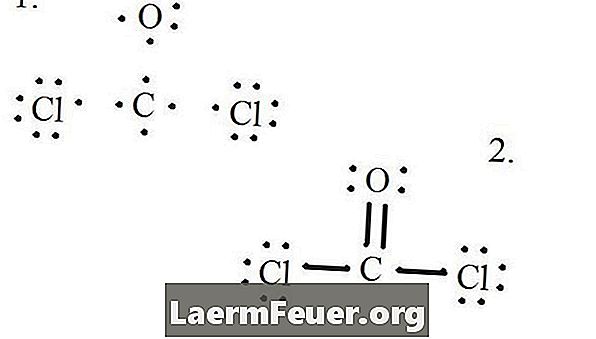
-
Atomi klorida dijele jednostruke veze s molekulom ugljika, dok atom kisika formira dvostruku vezu s ugljikom. Svaki atom u konačnoj strukturi zadovoljava pravilo okteta i ima osam elektrona u valentnom sloju, što omogućuje molekularnu stabilnost.
Lewisova struktura
-
Izračunajte parove slobodnih elektrona svakog atoma u Lewisovoj strukturi. Svaki atom označava elektron svake veze iz koje sudjeluje. Dodajte ove brojeve. U CoCl2: C = 0 slobodnih parova plus 4 vezna elektrona = 4 elektrona. O = 4 elektrona slobodnih parova plus 2 elektrona veza = 6 elektrona. Cl = 6 elektrona slobodnih parova i jedan elektron jedne veze s C = 7 elektrona.
-
Oduzmite količinu elektrona u valentnom sloju na nevezanom atomu. Rezultat je formalni naboj za svaki atom. U CoCl2: C = 4 valentnih elektrona (ev) u nevezanom atomu minus 4 elektrona označena u Lewisovoj strukturi (LS) = 0 formalni naboj O = 6 ev - 6 LS = 0 formalni naboj Cl = 7 i - 7 LS = 0 formalna optužba
Formalni naboji atoma
-
Kada pišete, stavite ove naboje blizu atoma u Lewisovoj strukturi. Ako ukupna molekula ima naboje, stavite Lewisovu strukturu u zagrade s nabojem napisanom izvana u gornjem desnom kutu.
Formalni naboj svakog atoma
upozorenje
- Izračun formalnog naboja za molekule koje sadrže prijelazne metale može biti izdajnički. Broj elektrona u valentnom sloju za prijelazne metale bit će oni iz uzorka plemenitog plina.
Što vam je potrebno
- Periodni sustav elemenata